




suivant: Calorimétrie
monter: Premier principe de la
précédent: Relations de Mayer
Table des matières
Index
Dans le cas des gaz parfaits monoatomiques:  ,
,
 et
et
 . Donc
. Donc
 .
.
Dans le cas des gaz parfaits diatomiques, les degrés de liberté internes interviennent différemment selon la température:
- a)
- pour T < 30 K: seuls les trois degrés de liberté de translation sont à considérer:
 et de nouveau
et de nouveau
 .
.
- b)
- pour 300 K < T < 2000 K (cas usuel): on a trois degrés de liberté de translation et deux degrés de liberté de rotation supplémentaires; d'après le théorème d'équipartition de l'énergie:
 et
et
 . Donc
. Donc
 .
.
- c)
- pour T > 2000 K: la molécule peut vibrer autour de son barycentre, mais la contribution énergétique de cette vibration est ``double'' (en
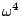 dans l'hamiltonien). Mais Les degrés de liberté de rotation s'avérant être négligeables devant ceux de rotation, il s'agit en somme du même cas que précédemment:
dans l'hamiltonien). Mais Les degrés de liberté de rotation s'avérant être négligeables devant ceux de rotation, il s'agit en somme du même cas que précédemment:

- d)
- pour T > 6000 K: on doit prendre en compte trois degrés de liberté de translation, les deux degrés de liberté de rotation ainsi que le degré de liberté de vibration (qui compte ``double''), ce qui donne en tout
 et
et
 et ainsi
et ainsi
 .
.





suivant: Calorimétrie
monter: Premier principe de la
précédent: Relations de Mayer
Table des matières
Index
Clément Baruteau
2003-04-30
![]() ,
,
![]() et
et
![]() . Donc
. Donc
![]() .
.