




suivant: Travail des forces de
monter: Premier principe de la
précédent: Transferts d'énergie
Table des matières
Index
Remarque: dans l'expression de l'énergie interne, on regroupe l'énergie cinétique microscopique associée au mouvement d'ensemble des molécules, ainsi que l'énergie potentielle d'interaction de ces différentes molécules entre elles. Rappelons enfin que, comme la plupart des énergies potentielles, l'énergie interne  est définie à une constante additive près.
est définie à une constante additive près.
Conséquences:
- -
- Le premier principe de la thermodynamique n'est rien d'aute que l'expression mathématique - équation (1.11) - de la conservation de l'énergie.
- -
-
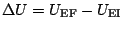 :
:  ne dépend que de l'état initial et de l'état final du système, et pas du type de transformation entre les deux.
ne dépend que de l'état initial et de l'état final du système, et pas du type de transformation entre les deux.
- -
-
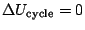 : si
: si  constante (
constante (
 ), alors
), alors 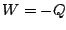 .
.
- -
- Pour un système isolé,
 ce qui signifie que la somme
ce qui signifie que la somme  est constante.
est constante.
Clément Baruteau
2003-04-30
![\fbox{
\begin{minipage}[]{11.7cm}
\par
{\bf Enoncé:} ~Pour tout système en équi...
...formation élémentaire, on écrira: $d(U+E) = \delta W +\delta Q$.
\end{minipage}}](img58.png)
![]() est définie à une constante additive près.
est définie à une constante additive près.