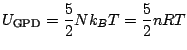suivant: Gaz réels
monter: Théorie cinétique des gaz
précédent: Définition cinétique de la
Table des matières
Index
En général, on définit l'énergie interne d'un gaz quelconque par:
Or il n'y a pas d'interaction entre molécules de gaz parfaits : le second terme est nul.
On distingue malgré tout deux cas :
- -
- celui du gaz parfait monoatomique (GPM): les molécules sont assimilées à leur centre de masse et seules les énergies cinétiques de translation sont à prendre en compte:
- -
- celui du gaz parfait polyatomique (GPP): il faut non seulement tenir compte de l'énergie cinétique de translation du centre de masse de chaque molécule de gaz, mais aussi de l'énergie cinétique barycentrique, notée
 , relative au mouvement désordonné des atomes dans le référentiel barycentrique
, relative au mouvement désordonné des atomes dans le référentiel barycentrique  de la molécule. On se contentera là encore de l'exemple du gaz parfait diatomique pour lequel se rajoutent deux degrés de rotation supplémentaires et ainsi, d'après le théorème d'équipartition de l'énergie (
de la molécule. On se contentera là encore de l'exemple du gaz parfait diatomique pour lequel se rajoutent deux degrés de rotation supplémentaires et ainsi, d'après le théorème d'équipartition de l'énergie (
 par terme quadratique dans l'hamiltonien du système):
par terme quadratique dans l'hamiltonien du système):
Dans tous les cas, nous retenons que l'énergie interne d'un gaz parfait ne dépend que de la température :
 |
(1.8) |





suivant: Gaz réels
monter: Théorie cinétique des gaz
précédent: Définition cinétique de la
Table des matières
Index
Clément Baruteau
2003-04-30