Il s'agit d'un système - a priori - isolé, il n'échange rien: son entropie d'échange est donc nulle. D'où
![]() . En fait, par convention, l'univers est un ``ensemble'' constitué du système étudié noté
. En fait, par convention, l'univers est un ``ensemble'' constitué du système étudié noté ![]() , des systèmes mécaniques parfaits notés
, des systèmes mécaniques parfaits notés
![]() , qui n'échangent de l'énergie que sous forme de travail, et enfin des vrais sources de chaleurs, notées
, qui n'échangent de l'énergie que sous forme de travail, et enfin des vrais sources de chaleurs, notées ![]() , qui n'échangent de l'énergie que sous forme de chaleur.
, qui n'échangent de l'énergie que sous forme de chaleur.
Pourquoi effectuer un bilan d'entropie sur un système? Essentiellement pour avoir accès à son entropie de création, qui détermine si la transformation qu'il subit est réversible ou pas. Deux cas se présentent:
- -
- soit le système est isolé, dans ce cas on effectue directement un bilan entropique sur le système en question.
- -
- soit le système n'est pas isolé, on doit effectuer un bilan d'entropie sur l'univers car seul le signe de
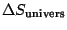 donne accès à l'entropie de création du système. En effet, l'extensivité de S donne:
donne accès à l'entropie de création du système. En effet, l'extensivité de S donne:
 , avec
, avec
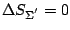 (on rappelle qu'un système mécanique parfait évolue de façon isentropique). De plus, la source de chaleur subit une transformation isotherme réversible; d'après (1.5.3), son entropie s'écrit:
(on rappelle qu'un système mécanique parfait évolue de façon isentropique). De plus, la source de chaleur subit une transformation isotherme réversible; d'après (1.5.3), son entropie s'écrit:

Donc
soit

(1.26)
- -
- S'il existe plusieurs sources, on a par extension,

(1.27)
- -
- Pour une pseudo source, on a par analogie,

(1.28)
Les trois inégalités précédentes permettent de déterminer l'inégalité de Carnot - Clausius: soit un système évoluant de façon cyclique, pour lequel
![]() car
car ![]() est un paramètre d'état, il vient donc
est un paramètre d'état, il vient donc
 |
(1.29) |
On a bien entendu égalité si la transformation est réversible; les autres expressions de cette inégalité sont:
![]() (si il existe plusieurs sources) ou encore
(si il existe plusieurs sources) ou encore
![]() (dans le cas d'une pseudo source).
(dans le cas d'une pseudo source).